Таллий

Таллий
Т а ллий (лат. Thallium), Tl, химический элемент III группы периодической системы Менделеева, атомный номер 81, атомная масса 204,37; на свежем разрезе серый блестящий металл; относится к редким рассеянным элементам. В природе элемент представлен двумя стабильными изотопами 203 Tl (29,5%) и 205 Tl (70,5%) и радиоактивными изотопами 207 Tl— 210 Tl — членами радиоактивных рядов. Искусственно получены радиоактивные изотопы 202 Tl (T1/2 = 12,5 сут), 204 Tl (T1/2 = 4,26 года) и 206 Tl (T1/2 = 4,19 мин). Таллий открыт в 1861 У. Круксом в шламе сернокислотного производства спектроскопическим методом по характерной зелёной линии в спектре (отсюда название: от греч. thall ó s — молодая, зелёная ветка). В 1862 французский химик К. О. Лами впервые выделил таллий и установил его металлическую природу.
Распространение в природе. Среднее содержание таллия в земной коре (кларк) 4,5 × 10 -5 % по массе, но благодаря крайнему рассеянию его роль в природных процессах невелика. В природе встречаются преимущественно соединения одновалентного и реже трёхвалентного таллия. Как и щелочные металлы, таллий концентрируется в верхней части земной коры — в гранитном слое (среднее содержание 1,5 × 10 –4 %), в основных породах его меньше (2 × 10 –5 %), а в ультраосновных лишь 1 × 10 –6 %. Известно лишь семь минералов таллия (например, круксит, лорандит, врбаит и др.), все они крайне редкие. Наибольшее геохимическое сходство таллий имеет с К, Rb, Cs, а также с Pb, Ag, Cu, Bi (см. Рассеянные элементы, Рассеянных элементов руды). Таллий легко мигрирует в биосфере. Из природных вод он сорбируется углями, глинами, гидроокислами марганца, накапливается при испарении воды (например, в озере Сиваш до 5 × 10 –8 г/л).
Физические и химические свойства. Таллий мягкий металл, на воздухе легко окисляется и быстро тускнеет. Таллий при давлении 0,1 Мн/м 2 (1 кгс/см 2 ) и температуре ниже 233 °С имеет гексагональную плотноупакованную решётку (а = 3,4496 ; с = 5,5137 ), выше 233 °С — объёмноцентрированную кубическую (а = 4,841 ), при высоких давлениях 3,9 Гн/м 2 (39000 кгс/см 2 ) — гранецентрированную кубическую; плотность 11,85г/см 3 ; атомный радиус 1,71 , ионные радиусы: Tl + 1,49 , Tl 3+ 1,05 ; tпл 303,6 °С; tкип 1457 °С, удельная теплоёмкость 0,130 кджl (кг × K) [0,031 кал/г × С)> при 20—100 °С; температурный коэффициент линейного расширения 28 × 10 –6 при 20 °С и 41,5 × 10 –6 при 240—280 °С; теплопроводность 38,94 вт/(м × К) [0,093 кал/(см × сек × °С)]. Удельное электросопротивление при 0°С (18 × 10 –6 ом × см) ; температурный коэффициент электросопротивления 5,177 × 10 –3 — 3,98 × 10 –3 (0—100 °С). Температура перехода в сверхпроводящее состояние 2,39 К. Таллий диамагнитен, его удельная магнитная восприимчивость —0,249 × 10 –6 (30 °С).
Конфигурация внешней электронной оболочки атома Tl 6s 2 6p 1 ; в соединениях имеет степень окисления +1 [Tl (I)] и + 3 [Tl (III)]. Таллий взаимодействует с кислородом и галогенами уже при комнатной температуре, с серой и фосфором при нагревании. Хорошо растворяется в азотной, хуже в серной кислотах, не растворяется в галогенводородных, муравьиной, щавелевой и уксусной кислотах. Не взаимодействует с растворами щелочей; свежеперегнанная вода, не содержащая кислорода, не действует на таллий. Основные соединения с кислородом: закись Tl2O и окись Tl2O3.
Закись таллия и соли Tl (I) нитрат, сульфат, карбонат — растворимы; хромат, бихромат, галогениды (за исключением фторида), а также окись таллия — малорастворимы в воде. Tl (III) образует большое число комплексных соединений с неорганическими и органическими лигандами. Галогениды Tl (III) хорошо растворимы в воде. Наибольшее практическое значение имеют соединения Tl (I).
Получение. В промышленных масштабах технический таллий получают попутно при переработке сульфидных руд цветных металлов и железа. Его извлекают из полупродуктов свинцового, цинкового и медного производств. Выбор способа переработки сырья зависит от его состава. Например, для извлечения таллия и др. ценных компонентов из пылей свинцового производства проводится сульфатизация материала в кипящем слое при 300—350 °С. Полученную сульфатную массу выщелачивают водой, и из раствора экстрагируют таллий 50%-ным раствором трибутилфосфата в керосине, содержащим йод, а затем реэкстрагируют серной кислотой (300 г/л) с добавкой 3%-ной перекиси водорода. Из реэкстрактов металл выделяют цементацией на цинковых листах. После переплавки под слоем едкого натра получают таллий чистотой 99,99%. Для более глубокой очистки металла применяют электролитические рафинирование и кристаллизационную очистку.
Применение. В технике таллий применяется, главным образом, в виде соединений. Монокристаллы твёрдых растворов галогенидов TIBr — TlI и TlCl — TlBr (известные в технике как КРС-5 и КРС-6) используют для изготовления оптических деталей в приборах инфракрасной техники; кристаллы TlCl и TlCl—TlBr — в качестве радиаторов счётчиков Черенкова. Tl2O входит в состав некоторых оптических стекол; сульфиды, оксисульфиды, селениды, теллуриды — компоненты полупроводниковых материалов, использующихся при изготовлении фотосопротивлений, полупроводниковых выпрямителей, видиконов. Водный раствор смеси муравьино- и малоновокислого таллия (тяжёлая жидкость Клеричи) широко применяют для разделения минералов по плотности. Амальгама таллия, затвердевающая при –59 °С, применяется в низкотемпературных термометрах. Металлический таллий используют для получения подшипниковых и легкоплавких сплавов, а также в кислородомерах для определения кислорода в воде. 204Tl в качестве источника b -излучении применяют в радиоизотопных приборах.
Таллий в организме. Таллий постоянно присутствует в тканях растений и животных. В почвах его среднее содержание составляет 10 –5 %, в морской воде 10 –9 %, в организмах животных 4 × 10 –5 %. У млекопитающих таллий хорошо всасывается из желудочно-кишечного тракта, накапливаясь главным образом в селезёнке и мышцах. У человека ежесуточное поступление таллия с продуктами питания и водой составляет около 1,6 мкг, с воздухом — 0,05 мкг. Биологическая роль таллия в организме не выяснена. Умеренно токсичен для растений и высоко токсичен для млекопитающих и человека.
Отравления таллием и его соединениями возможны при их получении и практическом использовании. Таллий проникает в организм через органы дыхания, неповрежденную кожу и пищеварительный тракт. Выводится из организма в течение длительного времени, преимущественно с мочой и калом. Острые, подострые и хронические отравления имеют сходную клиническую картину, различаясь выраженностью и быстротой возникновения симптомов. В острых случаях через 1—2 сут появляются признаки поражения желудочно-кишечного тракта (тошнота, рвота, боли в животе, понос, запор) и дыхательных путей. Через 2—3 нед наблюдаются выпадение волос, явления авитаминоза (сглаживание слизистой оболочки языка, трещины в углах рта и т. д.). В тяжёлых случаях могут развиться полиневриты, психические расстройства, поражения зрения и др. Профилактика профессиональных отравлений: механизация производственных процессов, герметизация оборудования, вентиляция, использование средств индивидуальной защиты.
Лит.: Химия и технология редких и рассеянных элементов, под ред. К. А. Большакова, т. 1, [М., 1965]; 3еликман А. Н., Меерсон Г. А., Металлургия редких металлов, М., 1973; Таллий и его применение в современной технике, М., 1968; Тихова Г. С., Дарвойд Т. И., Рекомендации по промышленной санитарии и технике безопасности при работе с таллием и его соединениями, в сборнике: Редкие металлы, в. 2, М., 1964; Воwen Н. Y. М., Trace elements in biochemistry, L.—N. Y., 1966.
Израэльсон З. И., Могилевская О. Я., Суворове. В. Вопросы гигиены труда и профессиональной патологии при работе с редкими металлами, М., 1973.
Таллий элемент. Свойства таллия. Применение таллия
Таллий – греческое имя, переводится как «зеленая ветвь». Почему так назвали химический элемент? Дело в цвете талия при сгорании. Пламя зеленое. Оно-то и помогло открыть металл. Это произошло в 1863-ем году. Английский ученый по фамилии Крукс завладел спектроскопом и отходами сернокислого завода немецкого города Тильперод.
Химик уже сотрудничал с предприятием, извлекая из промышленной пыли селен. Крукс заподозрил, что в ней есть и теллур . Ожидая увидеть в горелке спектроскопа линии этого элемента, ученый заметил травянистую полосу. Такой не было ни у одного из известных металлов. Крукс выделил новое вещество и дал ему имя.
Химические и физические свойства таллия
Таллий – металл голубовато-белого цвета. Элемент мягкий, не имеет вкуса, не пахнет. Это делает вещество особенно опасным, ведь талий ядовит. Коварны и проявления отравления. Симптомы близки к гриппу, бронхопневмонии и другим заболеваниям воспалительного характера.
При этом, исход нередко летальный. К смерти взрослого человека приводит всего 1 грамм таллия. Он впитывается не только в пищеварительном тракте, но и проникает через кожу, вдыхается вместе с воздухом.
Таллий – элемент, на 3-4-е сутки после принятия которого наступает эйфория. Это ложное ощущение здоровья и полноты жизни. Но, потом возвращаются тошнота, рвота, начинается понос, выпадение волос, трескаются углы рта. На этой стадии уже понятно, что имеешь дело не с гриппом, но, бывает уже поздно. Характерные симптомы проявляются через 1-2-е недели после отравления таллием.
Яд быстро окисляется, попадая в атмосферу. Поэтому, транспортируют элемент лишь в герметичных контейнерах. Содержание токсичного металла в воздухе не должно превышать 0,004 мг/м3. Для воды опасен показатель уже в 0,0001 мг/м3. В природе указанные уровни, как правило, не превышаются.
Таллий – редкий и рассеянный элемент. Повышенная концентрация наблюдается лишь в силезских марказитах и еще нескольких минералах. Силезия – область Германии. Но, таллий в ее недрах обнаружил в 1896-ом году русский химик и геолог Антипов.
Свойство таллия окисляться проявляется ярче при высоких температурах. Так, при 100-та градусах Цельсия металл покроется пленкой моментально. Поднимись температура еще втрое, вещество расплавится. Закипает таллий при 1460-ти градусах. Есть элементы, реакция с которыми проходит уже при комнатной температуре. В ней можно получить хлорид таллия, а так же, связать его с бромом и йодом.
В химических соединениях таллий бывает либо одна-, либо двухвалентный. Валентность – способность соединяться с атомами других веществ. Соответственно, 81-ый металл периодической системы образует связи по одному или трем направлениям.
Применение таллия
Отравление таллием может быть полезно для человека, если яд получили грызуны. Патентованный препарат для них изобрели в Германии в первой трети 20-го века. В отраву вошел сульфат таллия. Для зооцидов металл пригождается и в современности. Правда, в 20-ом веке препараты на основе 81-го элемента были повсеместны, а сейчас занимают не более 3% рынка.
Таллий, химические свойства металла, пригодились и в производстве фотоэлементов. В них помещают оксисульфид 81-го постояльца таблицы Менделеева . Вещество меняет электропроводность под действием света.
Читать еще: Хилак форте: инструкция по применениюОб этом свойстве оксисульфида таллия впервые написали в журнале Physical Review в 1920-ом году. Сделанные через 5 лет фотоэлементы оказались особо чувствительны к лучам инфракрасного спектра.
Хорошо пропускают инфракрасный свет бромиды и йодиды редкого металла. Поэтому, во времена Второй Мировой таллий купить захотели военные. Смешанные кристаллы взращивали в платиновых тиглях, чтобы потом поместить в инфракрасные сигнализации. Соединения таллия пригождались и при вычислении вражеских снайперов.
Таллий, электронная формула которого KLMN5s 2 5p 6 5d 10 6s 2 6p 1 Eион(Me=>Me + +e)=6,12эВ, имеет отношение и к загару. Он является реакцией кожи на ультрафиолетовое излучение, начинается активная выработка меланина – природного пегмента-красителя.
Однако, медикам известно, что не все лучи ультрафиолета «рождают» загар . Эффективны лишь эритимальные. Остальные лучи можно перевести в них. С задачей справляются силикаты и фосфаты некоторых металлов щелочноземельной группы. Для максимального действия элементы активируются таллием.
Цена таллия известна не только физиотерапевтам, но и врачам общей практики, трихологам. Металл входит в смеси для удаления волос. Процедура бывает необходима при поражении стригущим лишаем. К облысению приводят соли таллия. Главное, подобрать терапевтическую дозу. Чуть переборщишь, получишь токсичный, а не лечебный эффект.
Гидроксид таллия и карбонат – добавки в стекло с повышенным светопреломлением, а чистый металл пригождается в металлургии. 81-ый элемент добавляют в некоторые сплавы, чтобы сделать их устойчивыми к кислотам, более прочными и износостойкими.
Обычно, таллий становится компаньоном свинцовых смесей. 81-ый металл есть, к примеру, в подшипниковом сплаве. 8% таллия делают его лучше других составов на основе олова .
Сплавом является и амальгама таллия. Она твердеет лишь при 60-ти градусах Цельсия. Смесь нужна для производства термометров, используется в жидкостных затворах и переключателях. В контрольно-измерительной же аппаратуре пригождаются радиоизотопы таллия. Они служат чистым бето-излучателем.
Добыча таллия
Элемент добывают попутно, при переработке цинковых , свинцовых и медных руд. Получают металл, как когда-то это делал его первооткрыватель, из пылевых отходов производства. В год добыча таллия составляет примерно 10 тонн. Мировые же запасы элемента оцениваются в 17 тысяч тонн. Это 0,7 частей на миллион. То есть, хоть металл и редкий, но залежи его больше золотых.
Наиболее насыщенны таллием земли Европы, Канады и США. Но, в штатах с 1981-го года добыча ядовитого металла запрещена. Основным поставщиком элемента является Казахстан. Его поставщики предлагают рафинированный таллий. Его запасы связаны не только с рудами других металлов, но и с залегающими в земной коре пластами угля. В них сокрыты 630 тысяч тонн 81-го элемента.
Из минералов таллий содержат врбаит, лорандит, крукезит, гутчинсонит. Перечисленные камни встречаются редко. Зато, доля 81-го металла в них велика – от 16-ти до 80-ти процентов. За 90% зашкаливает содержание таллия в авиценните.
Это почти чистая окись трехвалентного металла открыта в 1956-ом году. Залежи камня нашли на территории Узбекской ССР. Ныне, она стала Казахстаном. Вот и объяснение, откуда страна берет сырье, чтобы снабжать таллием почти весь мировой рынок.
Цена таллия
За килограмм таллия просят почти 7 тысяч долларов. С 2003-го года цена выросла в 7 раз. Один Казахстан, хоть и производит много металла, но не может обеспечить им всех желающих. Канадский таллий дороже среднего. Выгодным предложением всегда были поставки из Китая.
Но, в Поднебесной решили устранить налоговые льготы при экспорте редкого элемента. Это способствовало уменьшению закупок. На мировом рынке начал ощущаться дефицит таллия, что и привело к росту цен на него.
Таллий – история открытия и основные вехи использования
Человечество познакомилось с таллием – тяжелым металлом тринадцатой группы Периодической системы практически полтора века назад в 1861 году. Его открытие – следствие исследования отходов сернокислотного производства.
Выделение элемента
В те времена, молодой англичанин, химик по образованию, Уильям Крукс изучал возможность выделения селена и теллура из промышленной пыли, обитая на севере Германии, в местечке Тилькерод. Теллур ученому обнаружить не удалось, как и избавить сернокислотное производство от осаждаемой пыли. Напротив, исследуя собранные образцы позднее, методами спектрального анализа, Крукс обнаружил ярко-зеленую линию, которую и отнес к новому элементу. Его название полностью соответствует увиденному англичанином спектру, поскольку таллий происходит от греческого термина, обозначающего «молодая зеленая ветвь».
Сульфосоль содержит металл таллий
Годом позже, ученый из Франции, химик Клод Лями, также занялся на досуге изучением шлама сернокислотного производства. Правда, делал он это в родной ему Франции, точнее на севере страны — городе Лоос. Аналогично Круксу, француз обнаружил новый элемент, благодаря спектральному анализу. Более того, Лями даже сумел выделить 14 грамм таллия, ведь сернокислотного шлама для этого у него было в избытке. Это помогло более детально изучить элемент, и отнести его к металлам (Крукс считал обнаруженное вещество аналогом селена). Таким образом, совместными усилиями англичанина и француза удалось выделить биологически токсичный элемент, который впоследствии станет полноправным участником детективных сюжетов.
Свойства и положения в Периодической таблице
Таллий занял 81-ую позицию, представляя собой металл серебристого цвета, отличающийся голубоватым оттенком. Вещество обладает плотностью, чуть свыше 11.885 грамм на кубический сантиметр и характеризуется низкой температурой плавления в 304 0 С. Этот металл отличается высокой пластичностью, мягок, его можно без проблем разрезать ножом. На воздухе чистый таллий быстро темнеет, вследствие образования оксидной пленки, препятствующей дальнейшему окислению металла. Талий диамагнитен, отличается высокой токсичностью, последняя характеристика присуща как самому металлу, так и его слоям, сульфатам.
Природные запасы вещества на два порядка превышают резервы золота и в 10 раз – серебра. При этом таллий, в отличие от этих драгоценных металлов – относится к типу рассеянных. Нет с памятью у элемента все в порядке, но особых его месторождений на планете не обнаружено. Наибольшее содержание таллия соответствует минералам с экзотическими наименованиями:
Так необычно выглядит минерал врбаит
В них элемент находится на уровне от 16 до 80%. Однако, все перечисленные минералы относятся к редким, так последние обнаружение авиценнита датируется серединой прошлого века.
Альтернативный источник таллия – дымоходы. Это неудивительно, поскольку открытие тяжелого металла также произошло, буквально, на пыли. Действительно, переплавка руд происходит при температурах, когда соединения таллия становятся летучими. Как результат, конденсируясь, они осаждаются на стенках дымохода вместе с пылью. В основном это окислы и сульфаты металла.
Производство в промышленных масштабах
Современным источником Tl выступают сульфидные металлические руды, а также отходы при производстве: меди, цинка, уже упоминавшейся серной кислоты.
Технология получения чистого таллия постоянно модифицируется, поскольку этот тяжелый металл извлекается из продуктов переработки в сопровождении ряда побочных элементов. Весь процесс выделения чистого Tl можно разбить на ряд этапов:
- Обогащение концентратов таллием, методом возгонки.
- Многократное повторное выщелачивание возгонов. Производится в воде посредством нагревания. Допускается также использование слабых растворов В редких случаях, когда таллий сочетается с трудно-растворимыми веществами, выщелачивание осуществляется разбавленной H2SO4.
- Поучение металлического таллия. В зависимости от выделенных соединений на первых двух этапах: хлорид, гидроксид, сульфид и прочие, — выбирают соответствующую технику очистки.
- Финальный этап отделения таллия. Выполняется цементацией очищенных растворов с применением цинковых пластин. Результат процесса – губчатый металл, впоследствии брикетируемый.
Чтобы получить более чистый таллий, требующийся для создания полупроводниковой техники, задействуют зонную плавку или кристаллофизическую фильтрацию.
Токсичность и другие сферы использования
Начало масштабного применения таллия приходится на второе десятилетие прошлого столетия. Именно тогда, на территории Германии появился патентованный ядовитый препарат для борьбы с грызунами, созданный на базе сульфата металла – Tl2SO4. Впоследствии, подобно применение вещества была резко ограничено, поскольку обнаружилось его токсичное воздействие на организм человека.
Установлено, что избыток таллия в организме приводит к облысению, отравлению. Благодаря этим свойствам, элемент продвигается по карьерной лестнице от должности «борец с грызунами» до героя детективных романов, где он используется в качестве медленно действующей отравы. Конечно, в реальной жизни желание купить таллий, как яд трудно исполнимо.
Видео: ТОП-10 самых опасных ядов (куда входит таллий)
Другое применение талия связано с изменением его электропроводности под действием фотонов. Это привело к созданию фотоэлементов (некоторые использовались в приборах ночного видения), где рабочим веществом выступает данный тяжелый металл. Высокая чувствительность в ИК диапазоне открыла таллию ряд альтернативных применений:
- оборудование для инфракрасной сигнализации;
- приспособления по обнаружению снайперов;
- сцинтилляционные счетчики.
Схема сцинтилляционного счетчика
В медицине таллий используется крайне осторожно, поскольку дозы его терапевтического и токсичного воздействия едва различимы. Можно выделить только применение солей элемента для удаления волос при стригущем лишае. В косметологических целях, силикаты щелочноземельных металлов, активированные Tl, используются в физиотерапии, для эритермального воздействия УФ излучения.
Среди других соединений, нашедших практическое применение можно выделить карбонат талия Tl2CO3, без которого не обходится производство стекол с высоким показателем преломления. Участие элемента в сплавах позволяет повысить такие характеристики, как:
- прочность;
- кислотная стойкость;
- износоустойчивость.
В частности, сплав для изготовления подшипников на базе свинца содержит 8% Tl. Среди прочих отраслей применения тяжелого металла можно выделить такие направления:
- Жидкостные переключатели, основанные на соединениях ртути и талия, функционируют в условиях отрицательных температур.
- Ускорители реакций в химической промышленности. Например, процесса восстановления нитробензола водородом.
- Аппаратура для контрольных измерений. При производстве бумаги и синтетических и искусственных тканей используется радиоактивность таллия, способствующая снятию статического напряжения с готовой продукции
Таким образом, несмотря на токсичность, которой наделен таллий, купить вещество существует множество причин. Об этом говорит и рост стоимости на этот металл. С 1920 года – начала использования элемента таллий, цена его выросла с 20 до 1300 долларов за килограмм.
Справочник Эколога
Здоровье твоей планеты в твоих руках!
Талий яд действие на человека
Кристалическая структура:
гексагональная
Таллий (лат.
thallium), tl, химический элемент iii группы периодической системы Менделеева, атомный номер 81, атомная масса 204,37; на свежем разрезе серый блестящий металл; относится к редким рассеянным элементам.
В природе элемент представлен двумя стабильными изотопами 203 tl (29,5%) и 205 tl (70,5%) и радиоактивными изотопами 207 tl — 210 tl — членами радиоактивных рядов . Искусственно получены радиоактивные изотопы 202 tl (t 1/2 = 12,5 сут ) , 204 tl (t 1/2 = 4,26 года) и 206 tl (t 1/2 = 4,19 мин ) .
Т. открыт в 1861 У. Круксом в шламе сернокислотного производства спектроскопическим методом по характерной зелёной линии в спектре (отсюда название: от греч. thall o s — молодая, зелёная ветка). В 1862 французский химик К. О. Лами впервые выделил Т. и установил его металлическую природу.
Читать еще: Препараты для очищения печениРаспространение в природе. Среднее содержание Т.
Отравление таллием: признаки и последствия
в земной коре (кларк) 4,5 ? 10 -5 % по массе, но благодаря крайнему рассеянию его роль в природных процессах невелика. В природе встречаются преимущественно соединения одновалентного и реже трёхвалентного Т. Как и щелочные металлы, Т. концентрируется в верхней части земной коры — в гранитном слое (среднее содержание 1,5 ?
10 –4 %), в основных породах его меньше (2 ? 10 –5 %), а в ультраосновных лишь 1 ? 10 –6 %. Известно лишь семь минералов Т. (например, круксит, лорандит, врбаит и др.), все они крайне редкие. Наибольшее геохимическое сходство Т. имеет с К, rb, cs, а также с pb, ag, cu, bi. Т. легко мигрирует в биосфере. Из природных вод он сорбируется углями, глинами, гидроокислами марганца, накапливается при испарении воды (например, в озере Сиваш до 5 ?
Физические и химические свойства. Т. мягкий металл, на воздухе легко окисляется и быстро тускнеет. Т. при давлении 0,1 Мн/м 2 (1 кгс/см 2 ) и температуре ниже 233 °С имеет гексагональную плотноупакованную решётку ( а = 3,4496 å; с = 5,5137 å), выше 233 °С — объёмноцентрированную кубическую ( а = 4,841 å), при высоких давлениях 3,9 Гн/м 2 (39000 кгс/см 2 ) — гранецентрированную кубическую; плотность 11,85 г / см 3 ; атомный радиус 1,71 å, ионные радиусы: tl + 1,49 å, tl 3+ 1,05 å; t пл 303,6 °С; t кип 1457 °С, удельная теплоёмкость 0,130 кджl ( кг ?
k ) [0,031 кал/г ? С) > при 20—100 °С; температурный коэффициент линейного расширения 28 ? 10 –6 при 20 °С и 41,5 ? 10 –6 при 240—280 °С; теплопроводность 38,94 вт/ ( м ?
К ) [0,093 кал/ ( см ? сек ? °С)]. Удельное электросопротивление при 0°С (18 ? 10 –6 ом ? см ) ; температурный коэффициент электросопротивления 5,177 ? 10 –3 — 3,98 ?
10 –3 (0—100 °С). Температура перехода в сверхпроводящее состояние 2,39 К. Т. диамагнитен, его удельная магнитная восприимчивость —0,249 ? 10 –6 (30 °С).
Конфигурация внешней электронной оболочки атома tl 6 s 2 6 p 1 ; в соединениях имеет степень окисления +1 [tl (i)] и + 3 [tl (iii)]. Т. взаимодействует с кислородом и галогенами уже при комнатной температуре, с серой и фосфором при нагревании. Хорошо растворяется в азотной, хуже в серной кислотах, не растворяется в галогенводородных, муравьиной, щавелевой и уксусной кислотах.
Не взаимодействует с растворами щелочей; свежеперегнанная вода, не содержащая кислорода, не действует на Т. Основные соединения с кислородом: закись tl 2 o и окись tl 2 o 3 .
Закись Т. и соли tl (i) нитрат, сульфат, карбонат — растворимы; хромат, бихромат, галогениды (за исключением фторида), а также окись Т. — малорастворимы в воде. tl (iii) образует большое число комплексных соединений с неорганическими и органическими лигандами.
Галогениды tl (iii) хорошо растворимы в воде. Наибольшее практическое значение имеют соединения tl (i).
Получение. В промышленных масштабах технический Т.
получают попутно при переработке сульфидных руд цветных металлов и железа. Его извлекают из полупродуктов свинцового, цинкового и медного производств. Выбор способа переработки сырья зависит от его состава.
Например, для извлечения Т. и др. ценных компонентов из пылей свинцового производства проводится сульфатизация материала в кипящем слое при 300—350 °С. Полученную сульфатную массу выщелачивают водой, и из раствора экстрагируют Т. 50%-ным раствором трибутилфосфата в керосине, содержащим йод, а затем реэкстрагируют серной кислотой (300 г/л ) с добавкой 3%-ной перекиси водорода.
Из реэкстрактов металл выделяют цементацией на цинковых листах. После переплавки под слоем едкого натра получают Т. чистотой 99,99%.
Для более глубокой очистки металла применяют электролитические рафинирование и кристаллизационную очистку.
Применение. В технике Т. применяется, главным образом, в виде соединений. Монокристаллы твёрдых растворов галогенидов tibr — tli и tlcl — tlbr (известные в технике как КРС-5 и КРС-6) используют для изготовления оптических деталей в приборах инфракрасной техники; кристаллы tlcl и tlcl—tlbr — в качестве радиаторов счётчиков Черенкова.
tl 2 o входит в состав некоторых оптических стекол; сульфиды, оксисульфиды, селениды, теллуриды — компоненты полупроводниковых материалов, использующихся при изготовлении фотосопротивлений, полупроводниковых выпрямителей, видиконов. Водный раствор смеси муравьино- и малоновокислого Т. (тяжёлая жидкость Клеричи) широко применяют для разделения минералов по плотности. Амальгама Т., затвердевающая при –59 °С, применяется в низкотемпературных термометрах. Металлический Т. используют для получения подшипниковых и легкоплавких сплавов, а также в кислородомерах для определения кислорода в воде.
204tl в качестве источника b -излучении применяют в радиоизотопных приборах.
Таллий в организме. Т. постоянно присутствует в тканях растений и животных. В почвах его среднее содержание составляет 10 –5 %, в морской воде 10 –9 %, в организмах животных 4 ? 10 –5 %. У млекопитающих Т. хорошо всасывается из желудочно-кишечного тракта, накапливаясь главным образом в селезёнке и мышцах.
У человека ежесуточное поступление Т. с продуктами питания и водой составляет около 1,6 мкг, с воздухом — 0,05 мкг. Биологическая роль Т. в организме не выяснена. Умеренно токсичен для растений и высоко токсичен для млекопитающих и человека.
Отравления Т. и его соединениями возможны при их получении и практическом использовании. Т. проникает в организм через органы дыхания, неповрежденную кожу и пищеварительный тракт.
Выводится из организма в течение длительного времени, преимущественно с мочой и калом. Острые, подострые и хронические отравления имеют сходную клиническую картину, различаясь выраженностью и быстротой возникновения симптомов. В острых случаях через 1—2 сут появляются признаки поражения желудочно-кишечного тракта (тошнота, рвота, боли в животе, понос, запор) и дыхательных путей. Через 2—3 нед наблюдаются выпадение волос, явления авитаминоза (сглаживание слизистой оболочки языка, трещины в углах рта и т.
д.). В тяжёлых случаях могут развиться полиневриты, психические расстройства, поражения зрения и др. Профилактика профессиональных отравлений: механизация производственных процессов, герметизация оборудования, вентиляция, использование средств индивидуальной защиты.
Лит.: Химия и технология редких и рассеянных элементов, под ред. К. А. Большакова, т. 1, [М., 1965]; 3еликман А. Н., Меерсон Г. А., Металлургия редких металлов, М., 1973; Таллий и его применение в современной технике, М., 1968; Тихова Г.
С., Дарвойд Т. И., Рекомендации по промышленной санитарии и технике безопасности при работе с таллием и его соединениями, в сборнике: Редкие металлы, в. 2, М., 1964; Воwen Н. y. М., trace elements in biochemistry, l.—n. y., 1966.
Израэльсон З. И., Могилевская О. Я., Суворове. В. Вопросы гигиены труда и профессиональной патологии при работе с редкими металлами, М., 1973.
Физико-химические свойства таллия и его соединений
Таллий представляет собой серебристо—белый мягкий металл, который был открыт спектроскопическим методом в 1861 г. W.Grookes и независимо от него A.. Lamy в 1862 г.
Десять смертельных ядов и их действие на человека
по характерной зеленой пинии в спектре (tallos — зеленая почка). Химические свойства таллия определяются его принадлежностью к побочной группе a-переходных металлов III группы элементов таблицы Менделеева.
Атомный вес таллия 204,39, атомный номер 81, плотность 11,85 г/см°. Температура плавления 303 С, температура кипения 1460°С.
Упругость паров таллия при температуре 825°С — 1, при 983 С — 10, при 1040°С — 20. при 1457°С — 760 мм-рт. ст. В химических соединениях он выступает как одновалентный или трехвалентный металл, образуя два рода соединений — закисные и окисные. На воздухе таллий покрывается пленкой закиси; при 100°С быстро окисляется с образованием TI2O и Tl2O3. С хлором, бромом и йодом реагирует при комнатной температуре. При взаимодействии со спиртами образует алкоголяты.
Легко растворяется в HNO3, Существуют соли и одно- и трехвалентного таллия (В.К. Григорович, 1970). Таллий является редким рассеянным элементом. Характер распределения его в природе определяется близостью по химическим свойствам и размерам ионных радиусов к щелочным металлам, а также к калькофильным элементам.
Промышленное значение как источники сырья для получения таллия имеют товарные концентраты сульфидов (сфалерит, галенит, пирит и марксцит). Таллий не извлекается непосредственно из руд и концентратов, содержащих его в количествах не выше тысячных долей процента.
Сырьем для промышленного его получения служат отходы и полупродукты производства цветных металлов. Содержание таллия в этих материалах колеблется в значительных пределах (от сотых допей процента до целых) и зависит не только от содержания таппия в исходном сырье, но и от характера производства и принятой технологии получения основного металла.
Таким образом, извлечение таллия связано с комплексной переработкой сырья и осуществляется попутно с получением других металлов. При низкой концентрации таллия в перерабатываемом cырье технология его производства на первой стадии сводится обычно к получению концентрата таппия, который затем перерабатывается на технический металл или его сопи.
В Советском Союзе производство таллия организовано на ряде свинцовых и цинковых заводов (Т.И. Дарвойд с соавт., 1968).
Окислы таллия
Известны 3 соединения таллия с кислородом: закись — Tl2O, охись — Tlg2O3 и перекись -Tl2O3 (мало изучена).
Таллий № 81 Tl
В истории открытия химических элементов таких как таллий немало парадоксов. Случалось, что поисками еще неизвестного элемента занимался один исследователь, а находил его другой. Иногда несколько ученых «шли параллельным курсом», и тогда после открытия (а к нему всегда кто-то приходит чуть раньше других) возникали приоритетные споры. Иногда же случалось, что новый элемент давал знать о себе вдруг, неожиданно. Именно так был открыт элемент № 81 — таллий.
В марте 1861 г. английский ученый Уильям Крукс исследовал пыль, которую улавливали на одном из серно-кислотных производств. Крукс полагал, что эта пыль должна содержать селен и теллур — аналоги серы. Селен он нашел, а вот теллура обычными химическими методами обнаружить не смог. Тогда Крукс решил воспользоваться новым для того времени и очень чувствительным методом спектрального анализа. В спектре он неожиданно для себя обнаружил новую линию .ветло-зеленого цвета, которую нельзя было приписать ни одному из известных элементов. Эта яркая линия была первой «весточкой» нового элемента. Благодаря ей он был обнаружен и благодаря ей назван по-латыни thallus — «распускающаяся ветка». Спектральная линия цвета молодой листвы оказалась «визитной карточкой» таллия.
В греческом языке (а большинство названий элементов берут начало в латыни или в греческом) почти так же звучит слово, которое на русский переводится как «выскочка». Таллий действительно оказался выскочкой — его не искали, а он нашелся.
Элемент со странностями
Больше 30 лет прошло после открытия Крукса, а таллий все еще оставался одним из наименее изученных элементов. Его искали в природе и находили, но, как правило, в минимальных концентрациях. Лишь в 1896 г. русский ученый И. А. Антипов обнаружил повышенное содержание таллия в силезских марказитах.
О таллии в то время говорили как об элементе редком, рассеянном и еще — как об элементе со странностями. Почти все это справедливо и в наши дни. Только таллий не так уж редок — содержание его в земной коре 0,0003% — намного больше, чем, например, золота, серебра или ртути. Найдены и собственные минералы этого элемента — очень редкие минералы лорандит TlASS2, врбаит Tl(As, Sb)3S5 и другие. Но ни одно месторождние минералов таллия на Земле не представляет интереса для промышленности. Получают этот элемент при переработке различных веществ и руд — как побочный продукт. Он действительно оказался очень рассеян.
И странностей в его свойствах, как говорится, хоть отбавляй. С одной стороны, таллий сходен со щелочными металлами. И в то же время он чем-то похож на серебро, а чем-то на свинец и олово. Судите сами: подобно калию и натрию, таллий обычно проявляет валентность 1+, гидроокись одновалентного таллия ТЮН — сильное основание, хорошо растворимое в воде. Как и щелочные металлы, таллий способен образовывать полииодиды, полисульфиды, алкоголяты. Зато слабая растворимость в воде хлорида, бромида и иодида одновалентного таллия роднит этот элемент с серебром. А но внешнему виду, плотности, твердости, температуре плавления — по всему комплексу физических свойств — таллий больше всего напоминает свинец.
И при этом он занимает место в III группе периодической системы, в одной подгруппе с галлием и индием, и свойства элементов этой подгруппы изменяются вполне закономерно.
Помимо валентности 1+, он может проявлять и естественную для элемента III группы валентность 3+. Как правило, соли трехвалентного таллия труднее рассворить, чем аналогичные соли таллия одновалентного. Последние, кстати, изучены лучше и имеют большее практическое значение.
Но есть соединения, в состав которых входит и тот и другой таллий. Например, способны реагировать между собой галогениды одно- и трехвалентного таллия. И тогда возникают любопытные комплексные соединения, в частности Тl1+ [Тl3+Сl2Вг2]
. В нем одновалентный таллий выступает в качестве катиона, а трехвалентный входит в состав комплексного аниона.
Подчеркивая сочетание различных свойств в этом элементе, французский химик Дюма писал: «Не будет преувеличением, если с точки зрения общепринятой классификации металлов мы скажем, что но объединяет в себе противоположные свойства, которые позволяют называть его парадоксальным металлом». Далее Дюма утверждает, что среди металлов противоречивый таллий занимает такое же место, какое занимает утконос среди животных. И в то же время Дюма (а он был одним из первых исследователей элемента № 81) верил, что «таллию суждено сделать эпоху в истории химии».
Эпохи он пока не сделал и не сделает, наверное. Но практическое применение он нашел (хотя и не сразу). Для некоторых отраслей промышленности и науки этот элемент по-настоящему важен.
Применение таллия
Таллий оставался «безработным» в течение 60 лет после открытия Крукса. Но к началу 20-х годов нашего столетия были открыты специфические свойства таллиевых препаратов, и сразу же появился спрос на них.
В 1920 г. в Германии был получен патентованный яд против грызунов, в состав которого входил сульфат таллия Tl2S04. Это вещество без вкуса и запаха иногда входит в состав инсектицидов и зооцндов и в наши дни.
В том же 1920 г. в журнале «Physical Review» появилась статья Кейса, который обнаружил, что электропроводность одного из соединений таллия (его оксисульфида) изменяется под действием света. Вскоре были изготовлены первые фотоэлементы, рабочим телом которых было именно это вещество. Особо чувствительными они оказались к инфракрасным лучам.
Другие соединения элемента № 81, в частности смешанные кристаллы бромида и иодида одновалентного таллия, хороша пропускают инфракрасные лучи. Такие кристаллы впервые получили в годы второй мировой войны. Их выращивали в платиновых тиглях при 470° С и использовали в приборах инфракрасной сигнализации, а также для обнаружения снайперов противника. Позже ТlВг и TlI применяли в сцинтилляционных счетчиках для регистрации альфа- и бета-излучения.
Общеизвестно, что загар на нашей коже появляется главным образом благодаря ультрафиолетовым лучам и что эти лучи обладают к тому же бактерицидным действием. Однако, как установлено, не все лучи ультрафиолетовой части спектра одинаково эффективны. Медики выделяют излучения эритемального, или эритемного (от латинского, aeritema — «покраснение»), действия — подлинные «лучи загара». И, конечно, материалы, способные преобразовывать первичное ультрафиолетовое излучение в лучи эритемального действия, очень важны для физиотерапии. Такими материалами оказались некоторые силикаты и фосфаты щелочноземельных металлов, активированные талием.
Медицина использует и другие соединения элемента № 81. Их применяют, в частности, для удаления волос при стригущем лишае — соли таллия в соответствующих дозах приводят к временному облысению. Широкому применению солей таллия в медицине препятствует то обстоятельство, что разница между терапевтическими и токсичными дозами этих солей невелика. Токсичность же таллия и его солей требует, чтобы с ними обращались внимательно и осторожно.
До сих пор, рассказывая о практической пользе таллия, мы касались лишь его соединений. Можно добавить, что карбонат таллия Тl2С03 используют для получения стекла с большим коэффициентом преломления световых лучей, д что же сам таллий? Его тоже применяют, хотя, может быть, не так широко, как соли. Металлический таллий входит в состав некоторых сплавов, придавая им кислотостойкость, прочность, износоустойчивость. Чаще всего таллии вводят в сплавы на основе родственного ему свинца. Подшипниковый сплав — 72% РЬ, 15%Sb, 5% Sn и 8% Тl превосхбдит лучшие оловянные подшипниковые сплавы. Сплав 70% РЬ, 20% Sn и 10% Т1 устойчив к действию азотной и соляной кислот.
Несколько особняком стоит его сплав с ртутью — амальгама таллия, содержащая примерно 8,5% элемента № 81. В обычных условиях она жидкая и, в отличие от чистой ртути, остается в жидком состоянии при температуре до —60° С. Сплав используют в жидкостных затворах, переключателях, термометрах, работающих в условиях Крайнего Севера, в опытах с низкими температурами.
В химической промышленности металлический таллий, как и некоторые его соединения, используют в качестве катализатора, в частности при восстановлении нитробензола водородом.
Не остались без работы и радиоизотопы таллия. Таллий-204 (период полураспада 3,56 года) — чистый бета- излучатель. Его используют в контрольно-измерительной аппаратуре, предназначенной для измерения толщины покрытий и тонкостенных изделий. Подобными установками с радиоактивным таллием снимают заряды статического электричества с готовой продукции в бумажной и текстильной промышленности.
Думаем, что уже приведенных примеров вполне достаточно, чтобы считать безусловно доказанной полезность элемента № 81. А о том, что таллий сделает эпоху в химии, мы не говорили — это все Дюма. Не Александр Дюма, правда (что при его фантазии было бы вполне объяснимо) , а Жан Батист Андрэ Дюма — однофамилец писателя, вполне серьезный химик.
Но, заметим, что и химикам фантазия приносит больше пользы, чем вреда.
ЕЩЕ НЕМНОГО ИСТОРИИ. Французский химик Лами открыл таллий независимо от Крукса. Он обнаружил зеленую спектральную линию, исследуя шламы другого сернокислотного завода. Он же первым получил немного элементарного таллия, установил его металлическую природу и изучил некоторые свойства. Крукс опередил Лами всего на несколько месяцев.
Минералы талия
В некоторых редких минералах — лорандите, врбаите, гутчинсоните, крукезите — содержание элемента № 81 очень велико — от 16 до 80%. Жаль только, что все эти минералы очень редки. Последний минерал таллия, представляющий почти чистую окись трехвалентного таллия ТlОз (79,52% Тl), найден в 1956 г. на территории Узбекскистана. Этот минерал назван авиценнитом — в честь мудреца, врача и философа Авиценны, или правильнее Абу Али ибн Сины.
Таллий в живой природе
Таллий обнаружен в растительных и животных организмах. Он содержится в табаке, корнях цикория, шпинате, древесине бука, в винограде, свекле и других растениях. Из животных больше всего таллия содержат медузы, актинии, морские звезды и другие обитатели морей. Некоторые растения аккумулируют таллий в процессе жизнедеятельности. Таллий был обнаружен в свекле, произраставшей на почве, в которой самыми тонкими аналитическими методами не удавалось обнаружить элемент № 81. Позже было установлено, что даже при минимальной концентрации таллия в почве свекла способна концентрировать и накапливать его.
НЕ ТОЛЬКО ИЗ ДЫМОХОДОВ. Первооткрыватель химического элемента нашел его в летучей пыли сернокислотного завода. Сейчас кажется естественным, что таллий, по существу, нашли в дымоходе — ведь при температуре плавки руд соединения таллия становятся летучими. В пыли, уносимой в дымоход, они конденсируются, как правило, в виде окиси и сульфата. Извлечь таллий из смеси (а, пыль — это смесь многих веществ) помогает хорошая растворимость большинства соединений одновалентного таллия. Их извлекают из пыли подкисленной горячей водой. Повышенная растворимость помогает успешно очищать таллий от многочисленных примесей. После этого получают металлический таллий. Способ получения металлического таллия зависит от того, какое его соединение было конечным продуктом предыдущей производственной стадии. Если был получен карбонат, сульфат или перхлорат таллия, то из них элемент № 81 извлекают электролизом; если же был получен хлорид или оксалат, то прибегают к обычному восстановлению. Наиболее технологичен растворимый в воде сульфат таллия Tl2S04. Он сам служит электролитом, при электролизе которого на катодах из алюминия оседает губчатый таллий. Эту губку затем прессуют, плавят и отливают в форму. Следует помнить, что таллий всегда получают попутно: попутно со свинцом, цинком, кадмием и некоторыми другими элементами. Таков удел рассеянных.
Самый легкий изотоп талия
У элемента № 81 два стабильных и 19 радиоактивных изотопов (с массовыми числами от 189 до 210). Последним в 1972 г. в Лаборатории ядерных проблем Объединенного института ядерных исследований в Дубне получен самый легкий изотоп этого элемента — таллий-189. Его получили, облучая мишень из дифторида свинца ускоренными протонами с энергией 660 Мэв с последующим разделением продуктов ядерных реакций на масс-сепараторе. Период полураспада самого легкого изотопа таллия оказался примерно таким же, как у самого тяжелого, он равен 1,4±0,4 минуты (у 210 Тl —1,32 минуты).
У собаки глисты, что делать? Виды, симптомы, лечение, профилактика. Глисты у собаки: симптомы, профилактика и лечение Многие собаководы часто сталкиваются...
17 05 2024 4:42:32
Для здоровья и красоты тела ешь орехи смело Men & Women Здоровье Красота Счастье Успех мужчин и женщин 20 самых полезных продуктов для здоровья и красоты...
16 05 2024 6:48:53
Эрготамина тартрат для лечения мигрени Эрготамина тартрат Эрготамина тартрат – это препарат (таблетки), соответствует группе психолептики. Важные...
15 05 2024 12:14:52
Сеть клиник «Столица» Сеть клиник "Столица" 5 секретов бодрости на весь день ⛹♀ . Согласитесь, каждый из нас хоть раз испытывал сонливость и усталость в...
14 05 2024 22:52:46
Опухоль яичников: удаление и прогноз выживаемости 1-4 стадии, рецидив Рак яичников – прогнозы выживаемости Статистика рака яичников В странах Западной...
13 05 2024 16:56:55
 Как выбрать мазь для лечения крапивницы: гормональные, негормональные, для взрослых и детей Негормональные мази от крапивницы – как выбрать?...
Как выбрать мазь для лечения крапивницы: гормональные, негормональные, для взрослых и детей Негормональные мази от крапивницы – как выбрать?...
12 05 2024 18:14:19
 Таблетки Цитрамон: инструкция, цена и отзывы Цитрамон П Цитрамон П - комбинированный препарат, действие которого обусловлено эффектами входящих в его...
Таблетки Цитрамон: инструкция, цена и отзывы Цитрамон П Цитрамон П - комбинированный препарат, действие которого обусловлено эффектами входящих в его...
11 05 2024 3:13:13
 Антипаразитарный чай: состав от паразитов своими руками в домашних условиях Как сделать антипаразитарный чай своими руками в домашних условиях?...
Антипаразитарный чай: состав от паразитов своими руками в домашних условиях Как сделать антипаразитарный чай своими руками в домашних условиях?...
10 05 2024 2:40:56
Снуп во время беременности: можно или нет Снуп во время беременности: можно или нет Редкая простуда или респираторная инфекция обходится без отёка...
09 05 2024 23:17:15
 7 причин отёка (опухоли) пальца на руке, что делать? Почему могут опухать пальцы на руке Чтобы точно знать, что делать, если опух палец на руке, важно...
7 причин отёка (опухоли) пальца на руке, что делать? Почему могут опухать пальцы на руке Чтобы точно знать, что делать, если опух палец на руке, важно...
08 05 2024 6:34:10
Как проявляется и лечится гипопигментация кожи Гипопигментация: Причины, виды и методы лечения Что такое гипопигментация? В этой статье мы расскажем о...
07 05 2024 4:42:45
Синовиома Синовиома: виды, симптомы, диагностика и лечение Синовиома – опухолевидное новообразование из клеток мягких тканей оболочек суставов....
06 05 2024 11:40:35
 Образование кист яичника у девочек Киста яичника у девочки-ребенка Киста яичника – это пузырь, который может быть наполнен жидкостью или железистыми...
Образование кист яичника у девочек Киста яичника у девочки-ребенка Киста яичника – это пузырь, который может быть наполнен жидкостью или железистыми...
05 05 2024 11:30:55
 Как понять, что он вас любит Как понять, что он вас любит 19.10.2015 Психология отношений Такое сложное и многогранное чувство, как любовь, формируясь,...
Как понять, что он вас любит Как понять, что он вас любит 19.10.2015 Психология отношений Такое сложное и многогранное чувство, как любовь, формируясь,...
04 05 2024 14:56:19
 Самые эффективные рецепты из тыквенных семечек с медом от простатита Тыквенные семечки с медом от простатита: польза и вред, рецепты, способ применения...
Самые эффективные рецепты из тыквенных семечек с медом от простатита Тыквенные семечки с медом от простатита: польза и вред, рецепты, способ применения...
03 05 2024 7:11:23
Как делают электрофорез с Новокаином Как делают электрофорез с Новокаином Довольно часто при некоторых заболеваниях врачи направляют пациентов на...
02 05 2024 18:26:15
 Лечение воспаленных миндалин у ребенка Советы родителям: как лечить тонзиллит у ребенка Тонзиллитом в медицинской терминологии называется...
Лечение воспаленных миндалин у ребенка Советы родителям: как лечить тонзиллит у ребенка Тонзиллитом в медицинской терминологии называется...
01 05 2024 4:51:37
Ротокан Ротокан – это препарат (экстракт), (фармакологическая группа – препараты для лечения функциональных нарушений со стороны жкт). Важные особенности...
30 04 2024 0:54:59
Можно ли пить молоко и молочные продукты? Молочные продукты для взрослых – вред или польза? О вопрос о том, надо или нет взрослым людям пить молоко,...
29 04 2024 2:37:35
 Можно ли есть груши при панкреатите? Можно ли употреблять груши при панкреатите? Здравствуйте! К моему сыну в гости приехала подруга и привезла целый...
Можно ли есть груши при панкреатите? Можно ли употреблять груши при панкреатите? Здравствуйте! К моему сыну в гости приехала подруга и привезла целый...
28 04 2024 19:41:55
Причины и способы лечения тошноты, рвоты при раке Как помочь пациенту, если он испытывает тошноту и рвоту Опубликовано в журнале: Сестринское дело »» №2...
27 04 2024 20:48:14
Как грамотно лечить диатез, чтобы избежать рецидивов? Как грамотно лечить диатез, чтобы избежать рецидивов? Родителям, которые беспокоятся о состоянии...
26 04 2024 6:27:21
СМ-Клиника на ул. Лесная (м. Белорусская) «СМ-Клиника» на ул. Лесная (м. «Белорусская») Адрес : ул. Лесная, д. 57, стр. 1 (м. «Белорусская»)....
25 04 2024 5:16:58
Левомицетин: инструкция по применению ЛЕВОМИЦЕТИН Показания к применению Способ применения Побочные действия Противопоказания Беременность Взаимодействие...
24 04 2024 20:44:21
 Симптомы повышенного уровня глюкозы (сахара) в крови Повышенный сахар в крови: симптомы и первые признаки Если человек полностью здоров, его не будет...
Симптомы повышенного уровня глюкозы (сахара) в крови Повышенный сахар в крови: симптомы и первые признаки Если человек полностью здоров, его не будет...
23 04 2024 9:36:53
 Как почувствовать себя лучше: 8 способов 15 способов почувствовать себя лучше в неудачный день «В каждом дне, в каждой вещи, какими бы темными и...
Как почувствовать себя лучше: 8 способов 15 способов почувствовать себя лучше в неудачный день «В каждом дне, в каждой вещи, какими бы темными и...
22 04 2024 15:30:10
Йод для щитовидной железы Список из 7 йодосодержащих продуктов, полезных для щитовидной железы Щитовидная железа – важный орган, который посредством...
21 04 2024 3:53:29
Милдронат при экстрасистолии ЖЕЛУДОЧКОВАЯ ЭКСТРАСИСТОЛИЯ НЕПОНЯТНОГО ГЕНЕЗА Доброе утро, Татьяна! Бицилин явно не нужен и не был нужен. Никаких критериев...
20 04 2024 4:45:17
Как долго лечат отит у детей? Отит – сколько длится у детей гнойный, через сколько проходит Практически все воспалительные процессы, проходящие в ушах,...
19 04 2024 20:54:45
Ложнодождевик обыкновенный: описание и употребление в пищу Можно ли есть гриб дождевик и как отличить съедобный от ядовитого (+21 фото)? Дождевики –...
18 04 2024 6:11:13
Как лечится перфорация носовой перегородки? Симптомы и лечение перфорации перегородки носа с операцией и без Перфорация перегородки носа напрямую не несет...
17 04 2024 17:34:43
 Тонометр с красной ртутью Ртутный тонометр Ртутные тонометры считаются эталоном точности для измерения артериального давления, это абсолютно отдельный вид...
Тонометр с красной ртутью Ртутный тонометр Ртутные тонометры считаются эталоном точности для измерения артериального давления, это абсолютно отдельный вид...
16 04 2024 1:11:20
 Что подарить на Новый Год 2018 — рейтинг самых популярных подарков Топ 10 самых популярных подарков на Новый год 2018 Среди множества предновогодних...
Что подарить на Новый Год 2018 — рейтинг самых популярных подарков Топ 10 самых популярных подарков на Новый год 2018 Среди множества предновогодних...
15 04 2024 0:57:55
Что предпринять после излечения меланомы для предотвращения рецидива Что предпринять после излечения меланомы для предотвращения рецидива После удаления...
14 04 2024 23:52:27
Офтальмогерпес (герпес на глазу) Как определить герпес на глазах и не допустить ошибок при лечении Герпес на глазах (офтальмогерпес) клинически сложное...
13 04 2024 15:58:37
Продукты, богатые клетчаткой для беременных и кормящих мам Продукты, богатые клетчаткой для беременных и кормящих мам Женщинам во время беременности и...
12 04 2024 2:38:16
 Симптомы и лечение лютеиновой кисты яичника Лютеиновая киста яичника Лютеиновая киста – это разновидность доброкачественного новообразования, которое...
Симптомы и лечение лютеиновой кисты яичника Лютеиновая киста яичника Лютеиновая киста – это разновидность доброкачественного новообразования, которое...
11 04 2024 3:10:35
 Алкоголь и диабет 2 типа: последствия употребления Можно ли употреблять алкоголь при сахарном диабете? Человек, страдающий сахарным диабетом, должен...
Алкоголь и диабет 2 типа: последствия употребления Можно ли употреблять алкоголь при сахарном диабете? Человек, страдающий сахарным диабетом, должен...
10 04 2024 0:57:57
Можно ли похудеть с помощью зеленого чая — личный опыт и отзыв Зеленый чай для похудения: отзывы, советы, рецепты Зеленый чай для похудения достаточно...
09 04 2024 10:39:35
 Может ли возникнуть аллергия на нервной почве: лечение ответа организма на определённое нервное перенапряжение Может ли возникнуть аллергия на нервной...
Может ли возникнуть аллергия на нервной почве: лечение ответа организма на определённое нервное перенапряжение Может ли возникнуть аллергия на нервной...
08 04 2024 11:48:47
Очищение кишечника касторовым маслом Касторка для очищения кишечника Общие сведения Если почитать многочисленные отзывы, становится понятно, что касторка...
07 04 2024 11:43:40
Как завоевать и удержать мужчину-Козерога на всю жизнь Практическое руководство по завоеванию мужчины Козерога По мнению астрологов, максимально...
06 04 2024 11:54:41
Когда применяется и чем грозит синовэктомия коленного сустава Синовэктомия колена В случае разрастания из-за чрезмерной регенерации соединительнотканной...
05 04 2024 11:13:45
 Торасемид Канон, табл. 5 мг №20 Торасемид Канон Торасемид Канон: инструкция по применению и отзывы Латинское название: Torasemide Canon Код ATX: С03СА04...
Торасемид Канон, табл. 5 мг №20 Торасемид Канон Торасемид Канон: инструкция по применению и отзывы Латинское название: Torasemide Canon Код ATX: С03СА04...
04 04 2024 10:12:13
Как зачать двоих малышей: факторы, советы и рекомендации Как зачать двоих малышей: факторы, советы и рекомендации Как зачать двойню? Все собранные в этой...
03 04 2024 5:57:43
 Грипп Грипп — симптомы, причины, виды, лечение и профилактика гриппа Грипп (grippus) — острое инфекционное заболевание дыхательных путей, вызванное...
Грипп Грипп — симптомы, причины, виды, лечение и профилактика гриппа Грипп (grippus) — острое инфекционное заболевание дыхательных путей, вызванное...
02 04 2024 10:44:22
Ключица человека: анатомия, строение, функции Ключица человека: анатомия, строение, функции Ключица – это единственное костное образование в теле...
01 04 2024 6:52:11
 Дермабарзия лица. Виды процедуры. Что такое дермабразия лица и как её делают? Даже самая эффективная механическая чистка лица не всегда дает нужный...
Дермабарзия лица. Виды процедуры. Что такое дермабразия лица и как её делают? Даже самая эффективная механическая чистка лица не всегда дает нужный...
31 03 2024 8:48:14
Симптомы и лечение герпеса у грудного ребенка Симптомы и лечение герпеса у грудничков и новорождённых детей Герпес – это часто встречаемое заболевание,...
30 03 2024 12:30:59
«Максиколд» для детей: инструкция по применению суспензии и аналоги препарата Максиколд суспензия для детей. Инструкция по применению Обязательно...
29 03 2024 17:34:48
Еще:
здоровье и качество жизни -1 :: здоровье и качество жизни -2 :: здоровье и качество жизни -3 :: здоровье и качество жизни -4 ::


 Очень сильные боли в животе при месячных. Как уменьшить менструальные боли: таблетки, препараты и народные средства от боли при месячных
Очень сильные боли в животе при месячных. Как уменьшить менструальные боли: таблетки, препараты и народные средства от боли при месячных 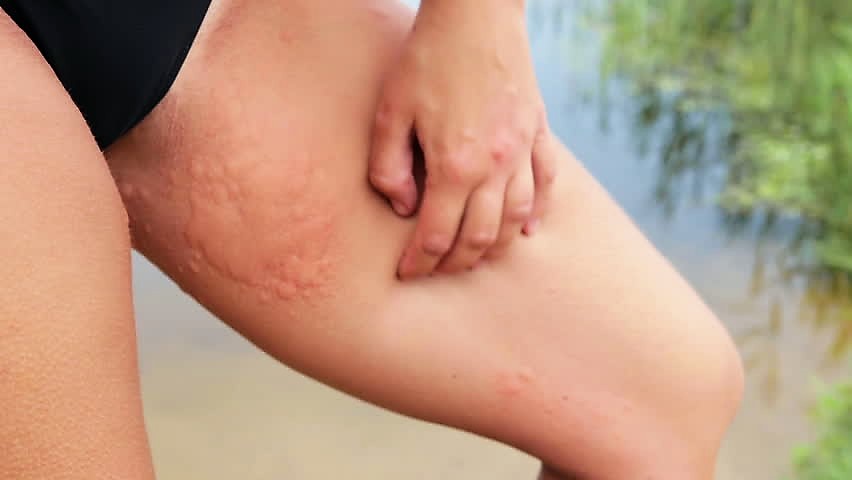 Волдыри на коже: виды и причины образования
Волдыри на коже: виды и причины образования  Нежирные сорта рыбы для диеты и способы ее приготовления
Нежирные сорта рыбы для диеты и способы ее приготовления  Подробно о том, как мыть шпица
Подробно о том, как мыть шпица  Укрепление коротких и длинных ногтей гелем — полезные советы
Укрепление коротких и длинных ногтей гелем — полезные советы  16 неделя беременности
16 неделя беременности  Лечебный шампунь от перхоти в аптеке: рейтинг лучших средств по отзывам покупателей
Лечебный шампунь от перхоти в аптеке: рейтинг лучших средств по отзывам покупателей  Программы и схемы оздоровления компании "Сибирское здоровье"
Программы и схемы оздоровления компании "Сибирское здоровье"  Одинокая женщина желает родить: все методики искусственного оплодотворения
Одинокая женщина желает родить: все методики искусственного оплодотворения  Иммуносупрессоры
Иммуносупрессоры  Выделения в первом триместре
Выделения в первом триместре  Лечебная диета № 5, при заболеваниях печени и желчного пузыря
Лечебная диета № 5, при заболеваниях печени и желчного пузыря  Список транквилизаторов, которые продают без рецептов врачей
Список транквилизаторов, которые продают без рецептов врачей 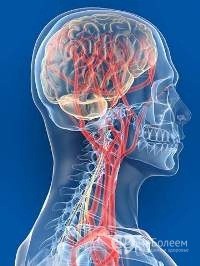 Симптоматика и лечение ангиодистонии
Симптоматика и лечение ангиодистонии 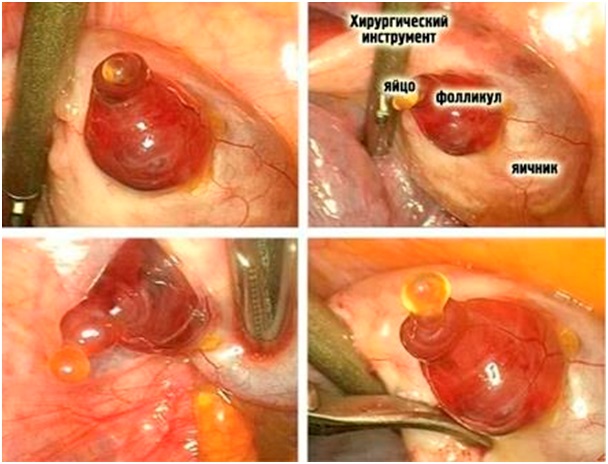 Как узнать, произошло ли зачатие после овуляции — первые признаки беременности
Как узнать, произошло ли зачатие после овуляции — первые признаки беременности  Обморок и потеря сознания: в чем разница? Как помочь человеку в бессознательном состоянии?
Обморок и потеря сознания: в чем разница? Как помочь человеку в бессознательном состоянии?  Какие тренажеры лучше использовать при сколиозе
Какие тренажеры лучше использовать при сколиозе  Лечебная физкультура при спондилоартрозе
Лечебная физкультура при спондилоартрозе  Как едят краба: уроки этикета
Как едят краба: уроки этикета  СОЭ у женщин — норма в анализе крови и причины повышения (+ таблица)
СОЭ у женщин — норма в анализе крови и причины повышения (+ таблица)  Как едят краба: уроки этикета
Как едят краба: уроки этикета  СМ-Клиника - Красногвардейский район
СМ-Клиника - Красногвардейский район  Список продуктов для гипоаллергенной диеты
Список продуктов для гипоаллергенной диеты  10 ранних признаков многоплодной беременности
10 ранних признаков многоплодной беременности  Высокий эстрадиол у женщин — признаки и методы нормализации гормона
Высокий эстрадиол у женщин — признаки и методы нормализации гормона  Что делать, если потеет попа — гипергидроз ануса
Что делать, если потеет попа — гипергидроз ануса  Как поможет ЛФК для восстановления коленных суставов при артрозе 1 и 2 степени?
Как поможет ЛФК для восстановления коленных суставов при артрозе 1 и 2 степени?  В каком возрасте можно начинать целоваться
В каком возрасте можно начинать целоваться  Смешанная флора в мазке: что это такое расшифровка
Смешанная флора в мазке: что это такое расшифровка  Как понять по ощущениям, что подсадка эмбриона прошла успешно
Как понять по ощущениям, что подсадка эмбриона прошла успешно  Измерение размера таза у беременных (норма для естественных родов)
Измерение размера таза у беременных (норма для естественных родов)  Работа палатной медицинской сестры высшей категории
Работа палатной медицинской сестры высшей категории  Диета и рекомендованный режим питания при долихосигме
Диета и рекомендованный режим питания при долихосигме  Можно ли ездить на велосипеде во время беременности?
Можно ли ездить на велосипеде во время беременности?  Продукты, сжигающие жир на животе и боках, правила питания
Продукты, сжигающие жир на животе и боках, правила питания  Как проходят третьи роды?
Как проходят третьи роды?  Когда опускается живот при беременности?
Когда опускается живот при беременности?  Способы повышения уровня прогестерона
Способы повышения уровня прогестерона  Если роды задерживаются
Если роды задерживаются  Сокращаем матку после родов: рекомендации для мам по приведению матки в тонус после беременности
Сокращаем матку после родов: рекомендации для мам по приведению матки в тонус после беременности  Пубертатный период у мальчиков — основные признаки
Пубертатный период у мальчиков — основные признаки  Иммунодепрессанты: классификация и описание
Иммунодепрессанты: классификация и описание  Сравниваем и выбираем: Вермокс, Декарис, Пирантел, Немозол, Вормил?
Сравниваем и выбираем: Вермокс, Декарис, Пирантел, Немозол, Вормил?  Топ 15 продуктов, которые нужно исключить из питания, чтобы похудеть
Топ 15 продуктов, которые нужно исключить из питания, чтобы похудеть  Как начинаются роды у первородящих
Как начинаются роды у первородящих  Какие упражнения нужно делать при коксартрозе тазобедренного сустава
Какие упражнения нужно делать при коксартрозе тазобедренного сустава  Лечебная диета при артрозе коленного сустава
Лечебная диета при артрозе коленного сустава  Недоношенные дети: выхаживание и вскармливание в первые дни жизни
Недоношенные дети: выхаживание и вскармливание в первые дни жизни 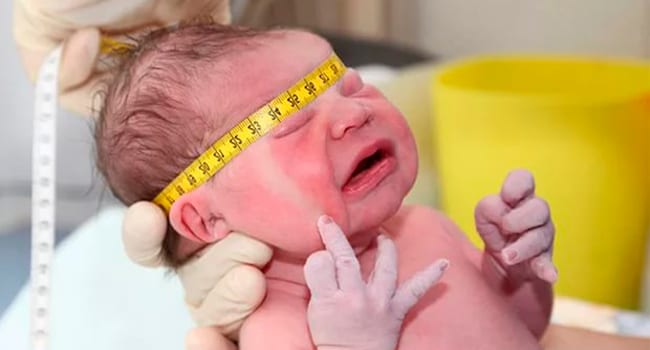 ПЭП у новорожденных
ПЭП у новорожденных  Беременность при поздней овуляции особенности течения
Беременность при поздней овуляции особенности течения  Питание по 3 положительной группе крови
Питание по 3 положительной группе крови  Гормонотерапия при раке молочной железы
Гормонотерапия при раке молочной железы  Воспаление околоушного лимфоузла
Воспаление околоушного лимфоузла  Подробно о вирусе герпеса 6 типа
Подробно о вирусе герпеса 6 типа 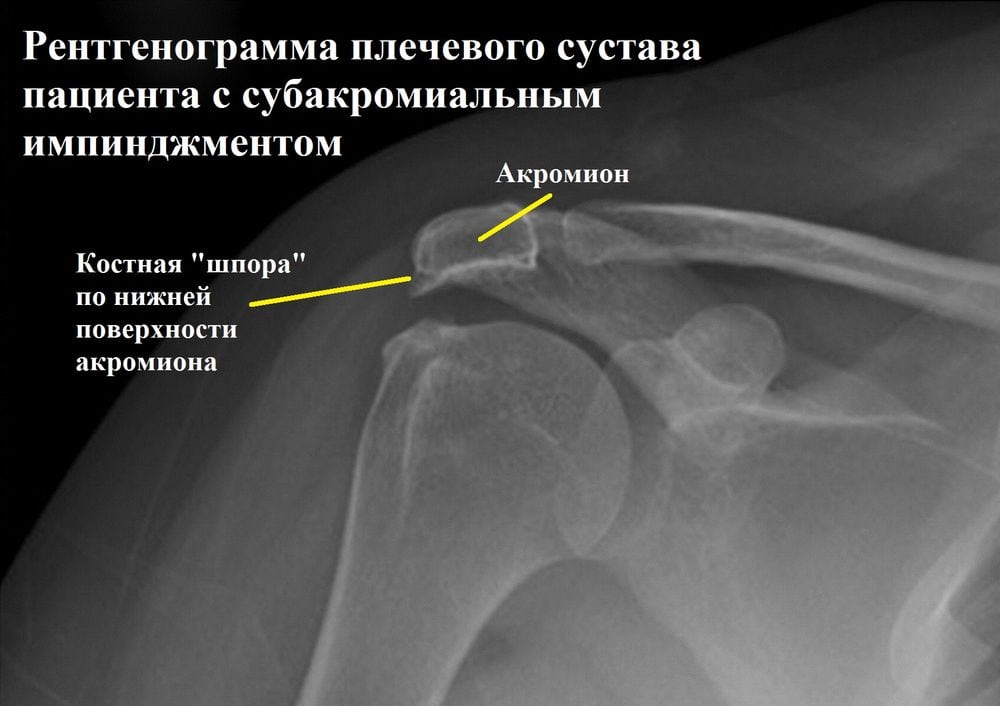 Импичмент синдром плечевого сустава
Импичмент синдром плечевого сустава  Как делать массаж шейно-воротниковой зоны
Как делать массаж шейно-воротниковой зоны  Диета при сахарном диабете 2 типа: таблица продуктов
Диета при сахарном диабете 2 типа: таблица продуктов  Монодиета на 10 дней
Монодиета на 10 дней  Принципы диеты при заболеваниях почек
Принципы диеты при заболеваниях почек  Обработка ран
Обработка ран 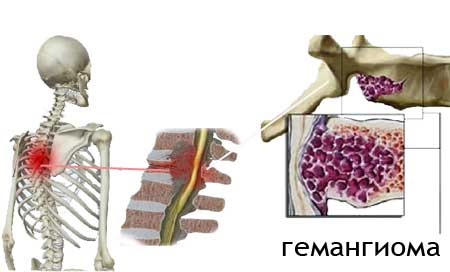 Гемангиома позвоночника – опасные размеры
Гемангиома позвоночника – опасные размеры  Особенности забора стволовых клеток у донора и последствия после процедуры
Особенности забора стволовых клеток у донора и последствия после процедуры  Высокая температура при онкологии 4 стадии о чем это говорит
Высокая температура при онкологии 4 стадии о чем это говорит  Чем опасно отравление во время беременности и что предпринять?
Чем опасно отравление во время беременности и что предпринять?  Что делать взрослому, если его укусила собака: отвечаем на популярные вопросы
Что делать взрослому, если его укусила собака: отвечаем на популярные вопросы  Есть ли вред от гипсокартона в квартире
Есть ли вред от гипсокартона в квартире